Plutonium – Element mit vielen Facetten
Andreas Kronenberg
Florida State University, Department of Chemistry, Tallahassee, FL 32306-4390, USA


Keywords: Plutonium, Actinides, Environmental Chemistry, Radiochemistry
Zusammenfassung
Plutonium ist ein relativer Neuling im Periodensystem der chemischen Elemente. In den 60 Jahren seit seiner Entdeckung wurde es in der Ă–ffentlichkeit aber bekannter als viele andere, ältere Elemente. Dieser Bekanntheitsgrad resultiert aber leider weniger von den vielfältigen, interessanten physikalischen und chemischen EigenÂschaften, sondern von der Verwendung in der zivilen und militärischen Nutzung der Kernenergie. Die nicht zutreffende Behauptung, dass Pu der giftigste Stoff der Welt sei, taten ihr ĂĽbriges. Ein Einblick in einige der besonderen Eigenschaften soll die faszinierende Welt des Plutoniums illustrieren.
Einleitung
Im Dezember 1941 bestrahlten G.T. Seaborg und seine Mitarbeiter von der Universität von Kalifornien in Berkeley Uranoxid mit Deuteronen von einem Zyklotron. In den folgenden Monaten gelang die erfolgreiche Isolierung einer neuen radioaktiven SubÂstanz, die mit der Kernladungszahl 94 identifiziert werden konnte. Dieses Element wurde nach dem Planeten Pluto Plutonium benannt, der als zweiter Planet im Sonnensystems nach Uranus folgt, so wie dieses Element im Periodensystem an zweiter Stelle hinter Uran steht.
Die Mitarbeiter des „Manhattan Projekts“ lernten von den Eigenschaften der ersten produzierten (unsichtbaren) Mengen Plutoniums auf das Verhalten von Makromengen zu schlussfolgern und produzierten nach Bestrahlung an verschiedenen Anlagen (verteilt über die ganze USA) innerhalb kürzester Zeit kg-Mengen dieses künstlichen Elements.
Von der Entdeckung des Plutoniums Anfang 1942 (Start des „Manhattan Projekts“ im August 1942) bis zur Zündung der ersten Pu-Bombe am 16. Juli 1945 (Trinity Test Site) und der Zerstörung Nagasakis am 9. August 1945 durch eine Pu-Bombe vergingen dabei nicht einmal 3 Jahre. Das Ende des Kalten Krieges bedeutete auch eine drastische Änderung in der Erforschung des Plutoniums. Neben der immer aktuellen Grundlagenforschung zu den f-Elementen und der Forschung um die Endlagerung, zielt die Forschung heute zunehmend auf die Beseitigung des Waffen-Plutoniums und die sichere Lagerung bzw. Wartung der verbliebenen Waffen. Dabei zeigt sich in den USA das Problem, dass viele Labors und Fabriken, die für einen Umgang mit Plutonium ausgelegt waren, zu schnell geschlossen und die Experten in den Ruhestand versetzt worden sind, ohne dass adäquater Nachwuchs ausgebildet wurde.
Elementares Plutonium
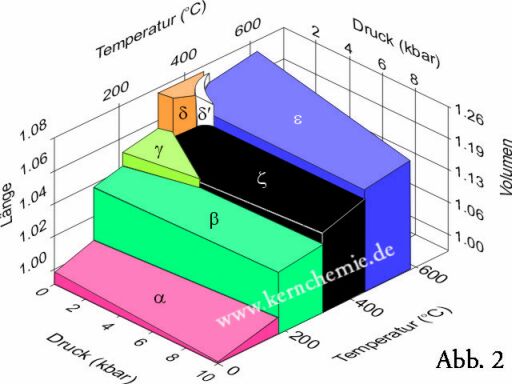
Reines Plutonium ist ein hochreaktives, stark reduzierendes, silberfarbenes Metall, das an der Luft sofort mit Sauerstoff und Luftfeuchtigkeit reagiert, dabei in wenigen Minuten trübe wird und nahezu alle Farben des Regenbogens durchläuft (siehe Abb. 1, links). Bei erhöhten Temperaturen ist es pyrophor. Seine Radioaktivität verursacht eine Selbstbestrahlung, so dass sich die Eigenschaften drastisch mit der Zeit ändern. Je nach Herstellungsprozess ist Pu spröde wie Glas oder duktil wie Aluminium. Zu den ungewöhnlichen Eigenschaften zählt, dass es sich beim Erstarren wie Wasser ausdehnt. Plutonium hat sechs verschiedene Kristallstrukturen (eine weitere siebte unter Kompression des Metalls mit mehr als 0,6 kbar). Dabei kann es seine Dichte um mehr als 25% ändern (siehe Phasendiagramm in Abb. 2).
Der Schmelzpunkt von 640 oC ist sehr niedrig (Beimischungen von 10 Atom-% Fe, Co oder Cu verschieben den Schmelzpunkt in den Bereich von 400 bis 450 oC), jedoch ist der Siedepunkt mit 3327 oC relativ hoch. Im geschmolzenen Zustand hat Plutonium eine sehr hohe Oberflächenspannung und die größte Viskosität von allen Elementen. Es ist ein außergewöhnlich schlechter elektrischer und thermischer Leiter. Das Abkühlen auf Temperaturen unterhalb der Raumtemperatur bringt weitere untypische Eigenschaften zu Tage. Der elektrische Widerstand, der bereits bei 273 Kelvin sehr hoch ist, nimmt bis zu 100 Kelvin weiter zu. Die Energie, die benötigt wird, um das Metall aufzuheizen, ist dann zehnmal höher als bei normaler Temperatur. Seine magnetische Suszeptibilität (ebenfalls bei Raumtemperatur bereits im Vergleich zu anderen Metallen sehr hoch) bleibt mit abnehmender Temperatur fast konstant, was auf eine Tendenz zu Magnetismus hinweist. Aber auch bei niedrigsten Temperaturen erreicht Plutonium niemals eine Fernordnung, wie das andere Metalle tun.
Eine Erklärung für dieses außergewöhnliche, nichtmetallische Verhalten von Plutonium liegt in seiner Elektronenstruktur. Die Actiniden können in zwei Gruppen unterteilt werden – in die leichteren, deren Eigenschaften von delokalisierten 5f Elektronen bestimmt werden und in die Transplutoniumelemente, deren Eigenschaften bei Normaldruck durch die Präsenz von lokalisierten 5f Elektronen herrühren. Delokalisierte Elektronen verursachen eher metallische Eigenschaften, während bei den anderen Stoffen der nichtmetallische Charakter ausgeprägt ist. Pu ist nun an der Grenze zwischen beiden stark unterschiedlichen elektronischen Eigenschaften und zeigt deshalb eine hohe Sensitivität auf Druck, Temperatur oder Legierungsbestandteile.
Verbindungen
Verbindungen von Plutonium in den Oxidationsstufen +3 bis +7 sind bekannt. Die meisten und gebräuchlichsten sind Oxide, sauerstoffhaltige Anionen und Halogenide. Diese Verbindungen haben eine groĂźe Vielzahl von Kristallstrukturen, Farben und anderen Eigenschaften, welche fĂĽr den Chemikern immer wieder neue ĂśberÂraschungen bereithalten. Die in den letzten Jahren am intensivsten untersuchte Verbindung ist das PuO2, welches als Kernbrennstoff verwendet wird. Es ist eine nicht-stöchiometrische Verbindung bis in Temperaturbereiche von ĂĽber 1250 oC, wo es sich entzĂĽndet. Versuche, höhere Oxide zu bilden, sind bisher fehlgeschlagen.

Lösungen
In Lösung kommt Plutonium in den Oxidationsstufen +3, +4, +5, +6 und +7 vor, wobei der Zustand +7 nur mit starken Oxidationsmitteln in basischen Lösungen zu erreichen ist. Die Redoxpotentiale zwischen den anderen Oxidationsstufen liegen sehr nahe beieinander, so dass sie in Lösungen teilweise nebeneinander vorliegen.
Disproportionierungs- und Elektronentransferreaktionen (z.B. kann Pu(IV) mit Pu(V) reagieren, was zu Pu(III) und Pu(VI) führt) machen die Studien zur Chemie in wässriger Lösung sehr komplex, da jeder Oxidationszustand seine eigene Koordinationschemie aufweist. Zusätzlich spielen Hydrolyse und Polymerisation in Lösungen eine wichtige Rolle.
Die optischen Spektren im sichtbaren Bereich für Plutoniumkationen sind elektronischen Übergängen zwischen verschiedenen f-Zuständen zuzuordnen. Diese Übergänge variieren bei verschiedenen Oxidationsstufen und Ligandenfeldern, so dass eine Vielzahl von Farben in Lösungen existieren. Abbildung 3 zeigt die Farben der verschiedenen Oxidationsstufen des Plutoniums in 1 M HClO4 (Pu(V) ist in NaClO4 bei pH=7, Pu(VII) ist in 2,5 M NaOH).
Umwelt
Pu(V) und Pu(VI) sind die unter natürlichen Bedingungen am häufigsten vorkommenden Oxidationsstufen. Das Löslichkeitsprodukt von Pu(OH)4 ist 10-54, was bedeutet, dass bei pH=8, weniger als ein Pu4+-Ion in etwa 1 000 000 Liter Wasser gefunden wird. Die hydrolysierten Pu4+ Ionen polymerisieren und „altern“ mit der Zeit, was zu einem unlöslichen Polymer führt, dass gegen stärkste Säuren beständig ist. Bei diesem Alterungsprozess werden Sauerstoffbrücken zwischen den Metallionen ausgebildet.
In Seewasser ist die gelöste Form PuO2+, welches in Konzentrationen von 10-14 M gefunden wird. Als PuO22+ hydrolysiert Plutonium leicht in neutralem Wasser und bei höheren Metallionenkonzentrationen werden Oligomere gebildet, die mehr als 5 Atome Pu pro Spezies haben.
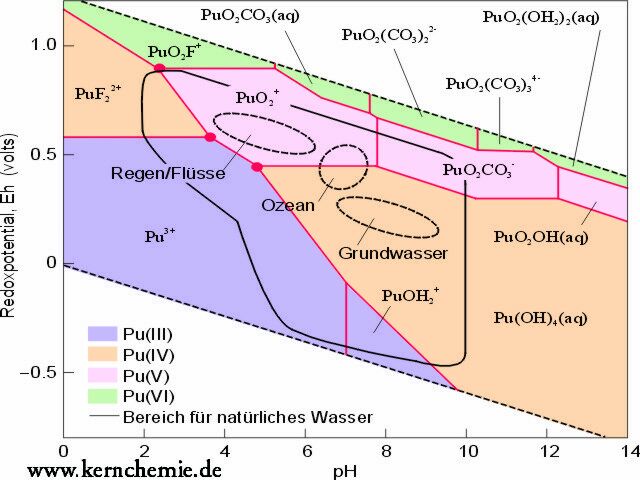
Abb. 4 deutet mit einem Redox-pH-Diagramm den weiten Bereich von möglichen Pu-Spezies in der Umwelt (am Beispiel von Wasser aus den Yucca Mountains, Nevada) an. Allgemein spielen die genauen geochemischen Bedingungen eine entscheidende Rolle. Das Vorhandensein von Sauerstoff, CO2, Fe(III) und organischen Verbindungen hat einen Einfluss auf das Redoxverhalten des Pu und die BioverfĂĽgÂbarkeit fĂĽr Mikroorganismen. Huminstoffe des Bodens komplexieren Plutonium und machen es unter bestimmten Bedingungen mobil. Actiniden können aber auch als Radiokolloide oder durch Sorption an mobilen Partikeln transportiert werden. In geringen Metallkonzentrationen spielen Sorptions-, Diffusions- und Desorptionsmechanismen an Tonen oder Gesteinsoberflächen eine wichtige Rolle.
Alle diese verschiedenen Parameter sind für die Modellierung des Migrationsverhaltens von Plutonium im Boden über die letzten Jahre intensiv untersucht worden und werden weiterhin intensiv erforscht. Diese Arbeiten werden durch die möglichen Szenarien für eine Endlagerung radioaktiver Abfälle aus der Gewinnung von Kernenergie motiviert. Dabei ist interessant, dass es vor mehr als 2 Milliarden Jahren einen natürlichen Kernreaktor in dem Uranvorkommen der späteren Mine von Oklo (Gabun) gab. Untersuchungen zeigen heute, dass die in diesem Reaktor (mit einer Gesamtleistung von rund 100 Milliarden kWhth) vor 2 Milliarden Jahren gebildeten etwa 4 Tonnen Plutonium auch ohne technische Barrieren am Ort ihrer Entstehung verblieben sind und sich nicht ausgebreitet haben.
Weitere Informationen zu Plutonium in der Umwelt, Giftigkeit, Analytik und zum Phänomen Oklo auf der Website:
Buchtip: The Plutonium Files. America’s Secret Medical Experiments in the Cold War. Eileen Welsome. A Delta Book, Published by Dell Publishing, a devision of Random House Inc., New York, October 2000 (ISBN 0-385-31954-1)
Legende zu allen Abbildungen
Titelbild: Das Foto Abb. 1a zeigt geschmolzenes Plutoniummetall in einer Vakuumdestillation. Die Schmelze wird von elektromagnetischen Feldern schwebend (ohne Kontakt zur Wand) gehalten. Americium und Gase dampfen hierbei aus. Die Schmelze enthält genug Gallium zur Stabilisierung der d-Phase von Plutoniummetall. Das Foto Abb. 1b zeigt eine Halbkugel von dem bei diesem Prozess gewonnen gallium-stabilisierten d-Phasen-Plutonium (mit kleiner 1,5 ppm Am-241). Mit freundlicher Genehmigung des Los Alamos National Laboratory.
Abb. 2: Phasendiagramm von Plutoniummetall
Abb. 3: Lösungen der verschiedenen Oxidationsstufen des Plutoniums. Jeder Oxidationszustand hat eine spezifische Farbe.
Abb. 4: Redox-pH-Diagramm für Plutonium im natürlichen aquatischen System. Der Kalkulation zugrunde liegende Konzentrationen für Hydroxid, Carbonat und Fluorid sind vergleichbar zu den Wässern in Yucca Mountain, Nevada. Die roten Punkte sind „triple points“, wo Plutonium in drei verschiedenen Oxidationsstufen existieren kann.
(Alle Rechte fĂĽr die Bilder bleiben beim Autor bzw. beim Los Alamos National Laboratory. Eine weitere Verwendung dieser Bilder ist nicht gestattet!)


Living textbook
of Nuclear Chemisty
